Experimentprinzip
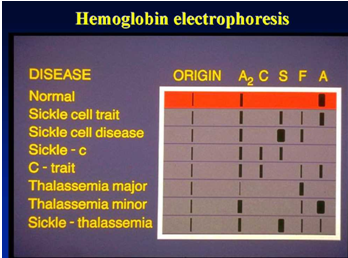
Ziel der Hämoglobin-Elektrophorese ist es, verschiedene normale und abnormale Hämoglobine zu erkennen und zu bestätigen.
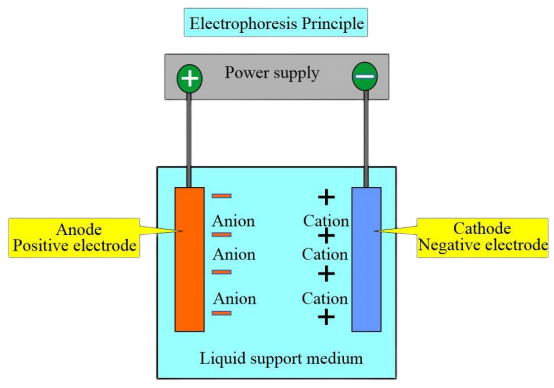
Aufgrund der unterschiedlichen Ladungen und isoelektrischen Punkte verschiedener Hämoglobintypen trägt Hämoglobin in einer bestimmten pH-Pufferlösung eine negative Ladung und wandert während der Elektrophorese zur Anode, wenn der isoelektrische Punkt von Hämoglobin niedriger als der pH-Wert der Pufferlösung ist. Umgekehrt bewegt sich Hämoglobin mit positiver Ladung zur Kathode.
Unter einer bestimmten Spannung und nach einer bestimmten Elektrophoresezeit weisen Hämoglobine mit unterschiedlichen Ladungen und Molekulargewichten unterschiedliche Migrationsrichtungen und -geschwindigkeiten auf. Dies ermöglicht die Trennung unterschiedlicher Zonen und die anschließende kolorimetrische oder elektrophoretische Scanning-Analyse dieser Zonen zur Quantifizierung verschiedener Hämoglobine. Die am häufigsten verwendete Methode ist die Celluloseacetat-Membranelektrophorese mit einem pH-Wert von 8,6.
Im Zytoplasma werden Ethylenglykolgruppen (CHOH-CHOH), die in Glykogen oder Polysaccharidsubstanzen (wie Mucopolysacchariden, Mukoproteinen, Glykoproteinen, Glykolipiden usw.) vorhanden sind, durch Periodsäure oxidiert und in Aldehydgruppen (CHO-CHO) umgewandelt. Diese Aldehydgruppen verbinden sich mit dem farblosen purpurroten Schiff-Reagens und bilden einen purpurroten Farbstoff, der sich dort ablagert, wo Polysaccharide in der Zelle vorhanden sind. Diese Reaktion ist als Periodic Acid-Schiff (PAS)-Färbung bekannt, früher auch als Glykogen-Färbung bezeichnet.
Experimentelle Methode
Materialien:CelluloseacetatmemBrane, Elektrophoresegerät(DYCP-38C und Netzteil DYY-6C), Überlegenes Probenladetool(Pipette), Spektrophotometer, kolorimetrische Küvetten, Puffer.
Puffer:
(1) TEB-Puffer pH 8,6: 10,29 g Tris, 0,6 g EDTA, 3,2 g Borsäure abwiegen und destilliertes Wasser auf 1000 ml hinzufügen.
(2) Boratpuffer: 6,87 g Borax und 5,56 g Borsäure abwiegen und destilliertes Wasser auf 1000 ml hinzufügen.
Verfahren:
PReparatur der Hämoglobinlösung
Nehmen Sie 3 ml Blut, das Heparin oder Natriumcitrat als Antikoagulans enthält. 10 Minuten lang bei 2000 U/min zentrifugieren und das Plasma verwerfen. Waschen Sie die roten Blutkörperchen dreimal mit physiologischer Kochsalzlösung (750 U/min, jeweils 5 Minuten Zentrifugation). 10 Minuten lang bei 2200 U/min zentrifugieren und den Überstand verwerfen. Fügen Sie die gleiche Menge destilliertes Wasser und dann das 0,5-fache Volumen Tetrachlorkohlenstoff hinzu. 5 Minuten lang kräftig schütteln und dann 10 Minuten bei 2200 U/min zentrifugieren, um die obere Hb-Lösung für die spätere Verwendung aufzufangen.
Einweichen der Membran
Schneiden Sie die Celluloseacetatmembran in Streifen von 3 cm × 8 cm. Weichen Sie sie in TEB-Puffer mit einem pH-Wert von 8,6 ein, bis sie vollständig gesättigt sind. Nehmen Sie sie dann heraus und tupfen Sie sie mit Filterpapier trocken.
Erkennen
Mit einer Pipette 10 μl der Hämoglobinlösung senkrecht auf die Celluloseacetatmembran (raue Seite) auftragen, etwa 1,5 cm vom Rand entfernt.
Elektrophorese
Gießen Sie die Boratpufferlösung in die Elektrophoresekammer. Platzieren Sie die Celluloseacetatmembran mit der gefleckten Seite am Kathodenende der Kammer. 30 Minuten bei 200 V laufen lassen.
Elution
Schneiden Sie die HbA- und HbA2-Zonen aus, geben Sie sie in separate Reagenzgläser und geben Sie 15 ml bzw. 3 ml destilliertes Wasser hinzu. Vorsichtig schütteln, um das Hämoglobin vollständig zu lösen, dann mischen.
Farbmetrik
Stellen Sie die Absorption mit destilliertem Wasser als Elutionslösung auf Null und messen Sie die Absorption bei 415 nm.
Berechnung
HbA2(%) = Absorption des HbA2-Röhrchens / (Absorption des HbA-Röhrchens × 5 + Absorption des HbA2-Röhrchens) × 100 %
Berechnung der experimentellen Ergebnisse
Referenzbereich für die TEB-Puffer-Celluloseacetat-Elektrophorese mit pH 8,6: HbA > 95 %, HbA2 1 %–3,1 %
Notizen
Die Elektrophoresezeit sollte nicht zu lang sein. Die Celluloseacetatmembran sollte während der Elektrophorese nicht austrocknen. Stoppen Sie die Elektrophorese, wenn HbA und HbA2 klar getrennt sind. Eine längere Elektrophorese kann zu Bandendiffusion und -unschärfe führen.
Vermeiden Sie es, zu viel Probe zu verwenden. Zu viel Hämoglobinflüssigkeit kann zur Bandablösung oder unzureichenden Färbung führen, was zu fälschlicherweise erhöhten HbA-Werten führt.
Verhindern Sie eine Kontamination der Celluloseacetatmembran mit Proteinen.
Der Strom sollte nicht zu hoch sein; Andernfalls kann es sein, dass sich die Hämoglobinbanden nicht trennen.
Beziehen Sie immer Proben von normalen Personen und die erforderlichen bekannten abnormalen Hämoglobine als Kontrollen mit ein.
Beijing Liuyi Biotechnology stellt den professionellen Elektrophoresetank für die Hämoglobin-Elektrophorese her, der das Modell darstelltDYCP-38CZelluloseacetat-Membran-Elektrophoresetank, und es gibt zwei Modelle der Elektrophorese-Stromversorgung für den Celluloseacetat-Membran-ElektrophoresetankDYY-2CUndDYY-6CStromversorgung.
Mittlerweile stellt Beijing Liuyi Biotechnology seinen Kunden Zelluloseacetatmembranen zur Verfügung, und die Größe der Zelluloseacetatmembranen kann individuell angepasst werden. Gerne können Sie uns nach Mustern und weiteren Informationen fragen.
Die Marke Beijing Liuyi hat eine mehr als 50-jährige Geschichte in China und das Unternehmen kann weltweit stabile und qualitativ hochwertige Produkte anbieten. Durch jahrelange Entwicklung ist es Ihre Wahl wert!
Wir sind jetzt auf der Suche nach Partnern, sowohl OEM-Elektrophoresetanks als auch Händler sind willkommen.
Wenn Sie einen Kaufplan für unsere Produkte haben, zögern Sie bitte nicht, uns zu kontaktieren. Sie können uns eine Nachricht per E-Mail senden[email protected]oder[email protected], oder rufen Sie uns bitte unter +86 15810650221 an oder fügen Sie WhatsApp +86 15810650221 oder Wechat hinzu: 15810650221
Zeitpunkt der Veröffentlichung: 20.09.2023